LAMP檢測技術與qPCR檢測技術的區別與不足LAMP檢測 與 qPCR檢測的區別與不足 二維碼
發表時間:2023-08-10 10:54 前幾篇文章我們分享了核酸檢測方法中LAMP檢測技術與qPCR檢測技術,那二者有何區別呢?今天小編就詳細說說LAMP檢測與qPCR檢測有何區別和不足。 擴增原理: LAMP:等溫擴增技術,且引物設計與擴增動力學都很復雜。 qPCR:在不同溫度下進行的循環性核酸擴增技術,通過熒光信號監測擴增產物的積累,實現定量分析。 溫度條件: LAMP:一個恒定的等溫環境(通常在60-65°C),對設備要求較低。 qPCR:qPCR需要多個溫度循環,包括變性、退火和延伸階段,需要精確的溫控設備。 引物設計: LAMP:使用多個引物,包括外部引物、內部引物和環引物。這些引物的設計相對復雜,要求特定的序列和結構。 qPCR:使用少量的引物(通常一對引物),引物設計相對簡單,需要特異性和合適的引物序列。 實時監測: LAMP:產物通常通過肉眼可見的方式來判斷,也可以使用熒光染料等進行增強。 qPCR:利用熒光探針或SYBR Green等熒光信號實時監測擴增產物的積累,可以定量分析。 LAMP與qPCR相比有哪些不足? 由于LAMP方法與qPCR方法各自的特點,導致這兩種檢測手段分別有其不同的適用范圍。
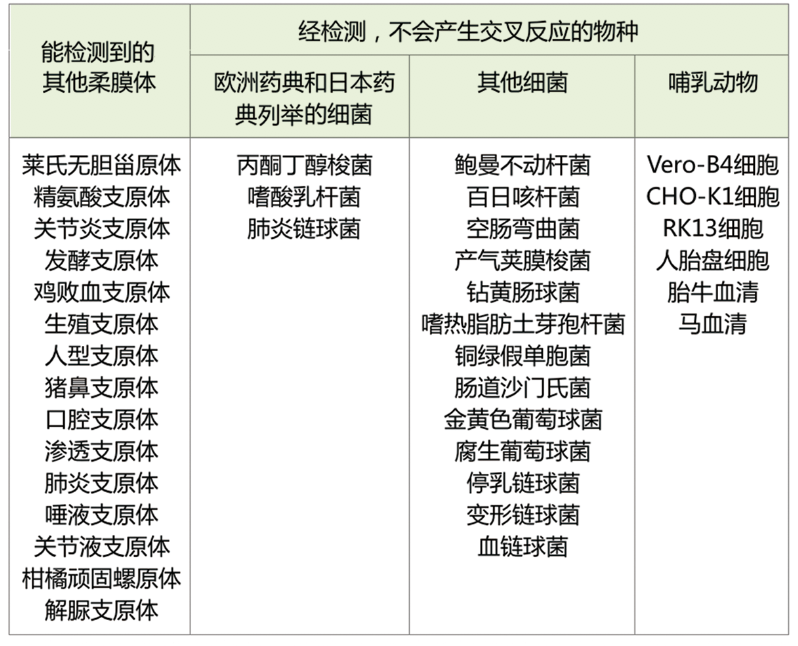
LAMP:適用于快速、初步的檢測,如一些疾病的早期篩查,野外環境中的檢測等。 如:臨床中的一些疾病檢測試劑盒。 qPCR:在精確定量和定性檢測方面表現出色,廣泛用于病原體檢測、基因表達分析等。 如:支原體qPCR檢測試劑盒 ①經典法qPCR試劑盒遵循歐洲藥典流程要求 ②高特異性,一次檢測即可涵蓋了所有可能感染細胞的支原體物種(涵蓋歐洲藥典規定的9種支原體),根據序列一致性,至少可以檢測到107種支原體物種。操作簡單,易于觀察(使用MB的試劑盒,下表中列出的支原體物種均為陽性,其他微生物或真核細胞均為陰性,無交叉反應)。
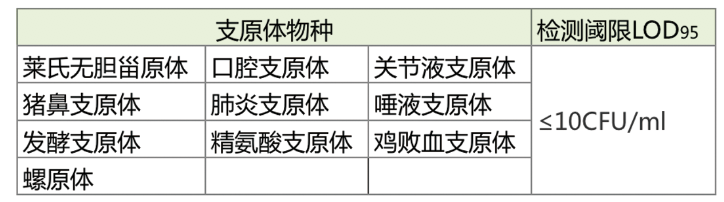
③高靈敏度,MB公司的支原體qPCR檢測試劑盒經典法最低檢測限可達到≤10CFU/ml。
MB公司的支原體qPCR檢測試劑盒一步法最低檢測限≥50個基因組/反應。 ④MB公司有相應配套的10CFU/100CFU的敏感度測試的標準品,便于方法學驗證。 ⑤MB公司有相應配套的支原體基因組DNA和細菌基因組DNA,便于特異性驗證。 ⑥MB公司有相應配套的支原體絕對定量標準品,便于最后定量檢測。 1.內控對照為獨立包裝,遵循歐洲藥典和日本藥典操作流程。 2.高特異性,一次檢測即可涵蓋所有常見易感染細胞的支原體物種(包括歐洲藥典規定的9種支原體)。與細菌和真核DNA無交叉反應。 3.高靈敏度,最低檢測限可達到≤10CFU/ml。 4.相應配套的支原體基因組DNA和細菌基因組DNA,便于特異性驗證。 5.有相應配套的支原體絕對定量標準品,便于最后定量檢測。 北京締一生物科技有限公司國內總代Ausbian品牌,德國Minerva-Biolabs微生物污染控制系列。細胞培養實驗使用的Ausbian澳洲進口特級胎牛血清,新生牛血清,干細胞培養基,馬血清,德國MB支原體檢測/祛除試劑盒,DNA污染祛除試劑,支原體PCR/qPCR定量試盒等產品。歡迎訪問締一生物官網:www.276mk.com。聯系電話:4006661688. |
|