淺談臨床項目申報中的支原體檢測臨床項目申報中的支原體檢測 二維碼
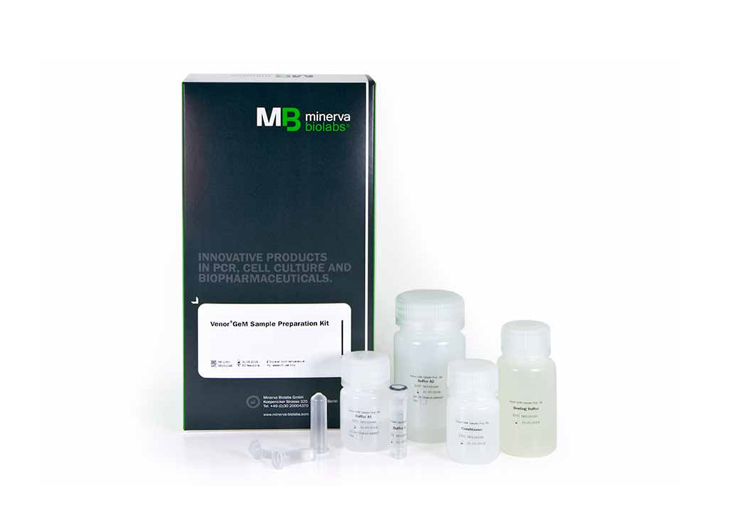
發(fā)表時間:2023-02-02 14:41 細胞體外培養(yǎng)過程中,很容易受到支原體污染的困擾。 在生物制品和細胞治療領(lǐng)域,支原體檢查是保證產(chǎn)品和治療安全的重要一環(huán)。生物源性原材料、采用細胞培養(yǎng)技術(shù)制備的疫苗、抗體,以及細胞或基因治療產(chǎn)品在生產(chǎn)過程的不同階段都要進行支原體污染的檢查。 歐洲藥典規(guī)定對細胞治療產(chǎn)品需要進行嚴格的支原體檢測;美國FDA規(guī)定為了提高細胞生物制品安全性,需要進行支原體污染檢測;我國藥典規(guī)定主細胞庫、工作細胞庫、病毒種子批、對照細胞以及臨床治療用細胞應(yīng)進行支原體檢測。 1、支原體檢測內(nèi)容 但在項目申報前,需要進行支原體檢測。 傳統(tǒng)支原體檢查方法是培養(yǎng)法和指示細胞培養(yǎng)法,并為藥典所認可和收錄。但由于這兩種方法耗時又耗力,因此,近年來,『支原體qPCR檢測』在工業(yè)領(lǐng)域的應(yīng)用越來越多。 但在項目申報前,先需要進行方法學(xué)驗證,依據(jù)藥典,在檢測限、特異性和耐用性方面達到要求后,才能替代傳統(tǒng)的檢查方法。 2、 支原體檢測好物推薦 適合臨床項目申報的支原體檢測和方法驗證,德國Minerva Biolabs(簡稱德國MB)公司已有成熟的產(chǎn)品及商業(yè)化應(yīng)用。 不僅提供有符合國際藥典的『支原體qPCR檢測』試劑盒,更有一系列支原體標準品及輔助產(chǎn)品,用于qPCR方法的全面驗證。
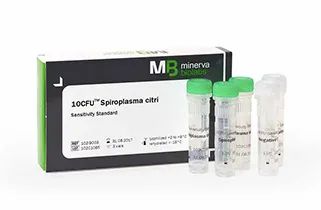
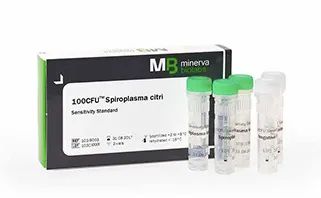
各國藥典對支原體核酸擴增檢測方法(簡稱NAT法)的驗證要求略有出入,但均要求對最低檢出限、特異性和耐用性進行驗證。 在檢測方法上,均建議先做樣本的支原體DNA抽提,再進行支原體檢測。 如使用商品化試劑盒,則除了需要試劑盒生產(chǎn)商提供完整的方法學(xué)驗證數(shù)據(jù)外,還需要使用者驗證試劑盒對其樣本的適用性,以及試劑盒表現(xiàn)出預(yù)期的性能(例如檢測限、耐用性、是否存在與細菌的交叉反應(yīng))進行證明。德國MB公司提供有10CFU檢測限的支原體高敏標準品,可同時用于檢測限和耐用性的驗證。了解更多Ausbian血清和Minerva微生物污染控制試劑,歡迎訪問締一生物官網(wǎng):www.276mk.com。 |
|