各國藥典對支原體qPCR檢測方法驗證的要求支原體qPCR檢測方法驗證的要求 二維碼
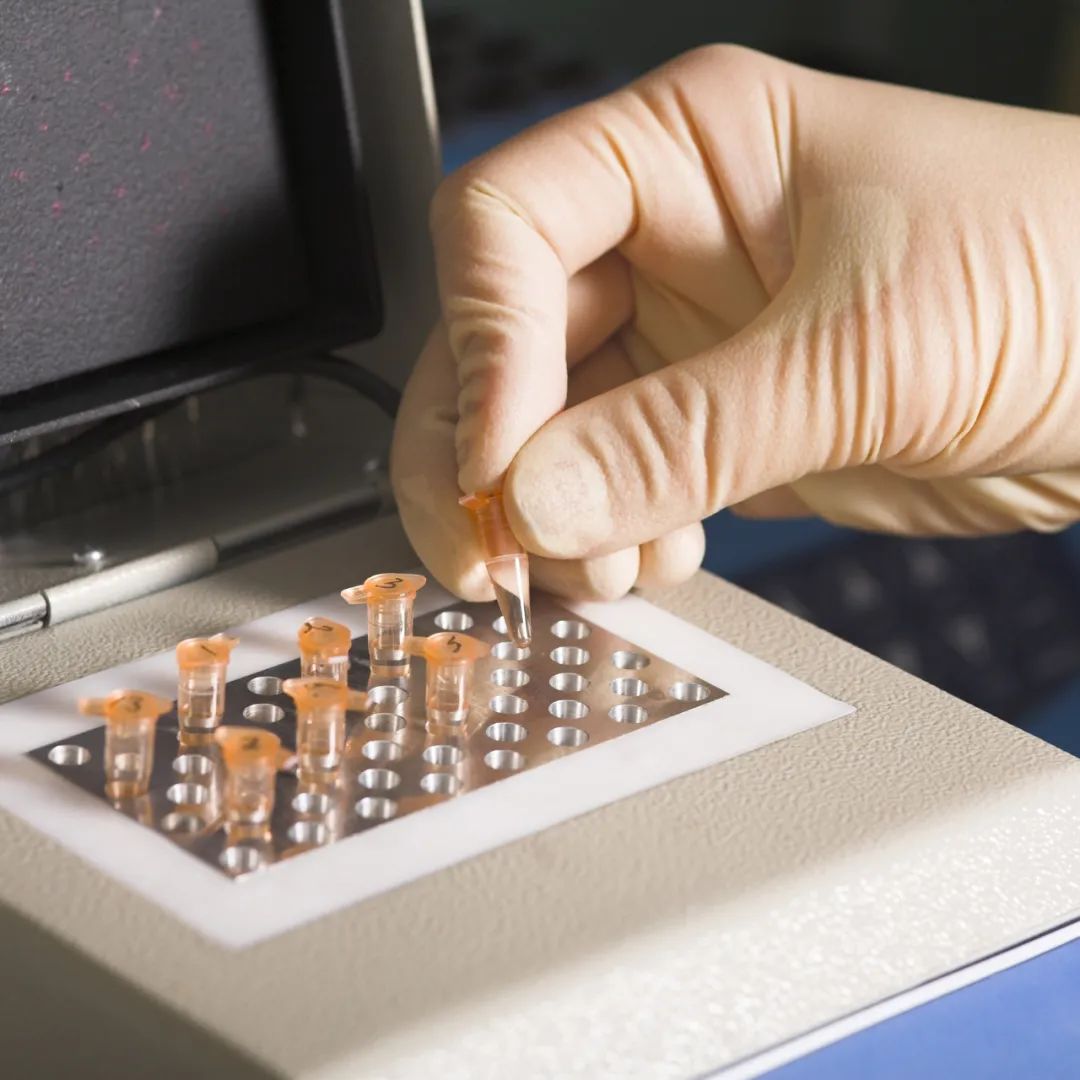
發表時間:2024-02-26 15:18 各國藥典對支原體核酸擴增檢測方法(簡稱NAT法)的驗證要求略有出入,但均要求對最低檢出限、特異性和耐用性進行驗證。在檢測方法上,均要求先做樣本的支原體DNA抽提,再進行支原體檢測。
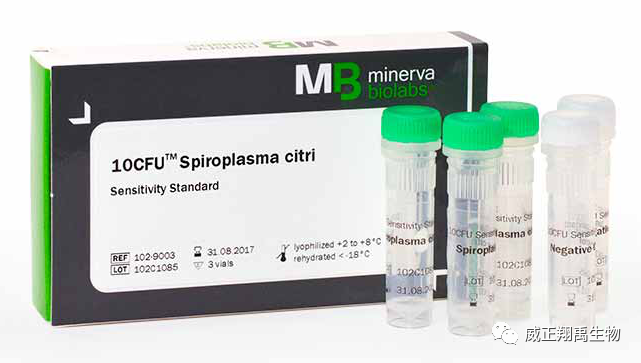
越來越多的廠商選擇使用商品化的支原體qPCR檢測試劑盒。 德國MB公司的支原體qPCR檢測試劑盒,被廣泛使用。Venor?GeM qEP利用定量、實時PCR (qPCR)快速(約3小時)和可靠的篩選細胞培養上清支原體污染。該試劑盒可與任何類型的實時PCR循環器結合使用,能夠檢測熒光染料FAM?和HEX?。特點: ①經典法qPCR試劑盒遵循歐洲藥典流程要求。 ②高特異性,一次檢測即可涵蓋了所有可能感染細胞的支原體物種(涵蓋歐洲藥典規定的9種支原體),根據序列一致性,至少可以檢測到107種支原體物種。操作簡單,易于觀察。 ③高靈敏度,MB公司的支原體qPCR檢測試劑盒經典法最低檢測限可達到≤10CFU/ml。 ④MB公司有相應配套的10CFU/100CFU的敏感度測試的標準品,便于方法學驗證。 ⑤MB公司有相應配套的支原體基因組DNA和細菌基因組DNA,便于特異性驗證。 ⑥MB公司有相應配套的支原體絕對定量標準品,便于最后定量檢測。 在使用商品化檢測試劑盒時,則除了需要試劑盒生產商提供完整的方法學驗證數據外,還需要使用者驗證試劑盒對其樣本的適用性,以及試劑盒表現出預期的性能(例如檢測限、耐用性、是否存在與細菌的交叉反應)。這些必須由使用者自己來證明。 在檢出限驗證中,歐洲藥典(簡稱EP)規定了污染細胞的常見9種支原體,要求NAT如替代培養法,對這9種支原體的檢測限需均達到10CFU/ml。其中如果生產中未采用昆蟲或植物源材料,可不必檢檸檬螺原體(Spiroplasma citri);如果生產中未使用或暴露于禽源材料,可不必檢關節液支原體(M. synoviae)。 日本藥典(簡稱JP)中的驗證要求與EP基本一致,但在最低檢出限驗證中,JP 17未提及雞敗血支原體,但增加了唾液支原體的驗證。 最終待驗證的支原體物種的選擇,在依據藥典基礎上,還需根據支原體污染風險大小而定。污染風險的影響因素有支原體寄生的宿主細胞的特異性、原材料的來源、產品的應用領域等。
德國MB公司提供有10CFU支原體高敏標準品,可同時用于檢測限和耐用性的驗證。 在NAT法的特異性驗證方面,歐洲藥典EP2.6.7指出,梭菌、乳酸桿菌和鏈球菌與支原體具有較近親緣關系,應優先選擇進行驗證。 至于更具體的驗證方案,還需要使用者針對自己的產品以及流程自行設計,德國MB公司也可協助完善。 |
|